Ammoniakkivesi: valmistelu, kaava, käyttö
Väritön kaasu, jossa on voimakas NH-ammoniakki3 ei vain liukenevat hyvin veteen lämmön vapautuksella. Aine aktiivisesti vuorovaikutuksessa H-molekyylien kanssa2O heikosti alkalin muodostumisen kanssa. Ratkaisu sai useita nimiä, joista toinen oli ammoniakkivesi. Yhdisteellä on yllättäviä ominaisuuksia, jotka ovat muodostumisen, koostumuksen ja kemiallisten reaktioiden tapaan.
Ammoniumionien muodostuminen

Ammoniumioni, jossa on yksi positiivinenlataus ja erityinen heikko kovalenttinen sidos - lahjoittaja-akseptori. Sen koon, varauksen ja muiden ominaisuuksien mukaan se muistuttaa kaliumkationia ja käyttäytyy kuin alkalimetallit. Epätavallisen kemiallisesti yhdiste reagoi happojen kanssa, muodostaa suolat, joilla on erittäin käytännöllinen merkitys. Nimitykset, joissa valmisteen ominaisuudet ja aineen ominaisuudet heijastuvat:
- ammoniakkivesi;
- ammoniumhydroksidi;
- ammoniakin hydraatti;
- akridiammonium.
varotoimenpiteitä
Varovaisuutta on noudatettava, kun työskentelet ammoniakin ja sen johdannaisten kanssa. On tärkeää muistaa:
- Ammoniumvesi on epämiellyttävä hajua. Vapautunut kaasu ärsyttää nenän ontelon limakalvopinta, silmä, aiheuttaa yskää.
- Kun ammoniakkia varastoidaan ammoniakkiin tiukasti suljetuissa pulloissa, ampulleja emittoidaan ammoniakkia.
- Voit tunnistaa ilman laitteita, hajuilla, jopa pienellä määrällä kaasua liuoksessa ja ilmassa.
- Molekyylien ja kationien välinen suhde liuoksessa vaihtelee eri pH: ssa.
- Noin 7: n arvolla myrkyllisen kaasun NH-konsentraatio3, elävien organismien vähemmän haitallisten NH-kationien määrä kasvaa4+
Ammoniumhydroksidin valmistus. Fysikaaliset ominaisuudet
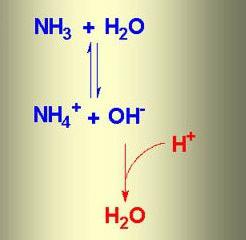
Kun ammoniakki liuotetaan veteen, muodostuu ammoniakin vettä. Tämän aineen kaava on NH4OH, mutta itse asiassa on samanaikaisesti ioneja
NH4+, OH-, NH3 ja H2O. Ammoniakin ja veden välisen ioninvaihdon kemiallisessa reaktiossa syntyy tasapainotila. Prosessi voidaan heijastaa sellaisen järjestelmän avulla, jossa vastakkain suunnatut nuolet ilmaisevat ilmiöiden palautettavuutta.
Laboratoriossa valmistetaan ammoniakki - vettäkokeita typpeä sisältävien aineiden kanssa. Kun ammoniakkia sekoitetaan veden kanssa, saadaan kirkas, väritön neste. Korkeissa paineissa kaasun liukoisuus kasvaa. Vesi antaa enemmän liuotettua ammoniakkia, kun lämpötila nousee. Teollisuustarpeisiin ja maatalouteen teollisessa mittakaavassa saadaan ammoniakin liukenemisesta 25 prosenttia. Toisessa menetelmässä käytetään koksiuunikaasun reaktiota veden kanssa.
Ammoniumhydroksidin kemialliset ominaisuudet
Kosketettaessa kaksi nesteä - ammoniakki vettäja suolahappoa - peitetään valkoisen savun klubeilla. Se koostuu reaktiotuotteen partikkeleista - ammoniumkloridista. Epäpuhtaalla aineella, kuten kloorivetyhapolla, reaktio tapahtuu suoraan ilmassa.

Ammoniakkivedyn heikosti alkaliset kemialliset ominaisuudet:
- Aine hajoaa reversiivisesti veteen ammoniumkationin ja hydroksidi-ionin muodostamiseksi.
- NH: n läsnä ollessa4+ väritön fenolftaleiiniliuos muuttuu harmaasävyiseksi, kuten alkaloilla.
- Neutraloinnin kemialliset reaktiot happojen kanssa johtavat ammonium- ja vesisuolojen muodostumiseen: NH4OH + HC1 = NH4Cl + H2O.
- Ammoniakkivesi joutuu ioninvaihtoreaktioihin metallisuolojen kanssa, joille heikot emäkset vastaavat, samalla kun muodostuu veteen liukenematonta hydroksidia: 2NH4OH + CuCl2 = 2NH4Cl + Cu (OH)2 (sininen saostuma).
Ammoniakkivesi: sovellus talouden eri osa-alueilla
Epätavallista ainetta käytetään laajalti arjessa,maatalous, lääketiede, teollisuus. Teknistä ammoniakkidraattia käytetään maataloudessa, kalsinoidun soodan, väriaineiden ja muiden tuotteiden valmistuksessa. Nestemäisessä lannoitteessa typpi on sellaisessa muodossa, jota kasvit helposti yhdistävät. Ainetta pidetään kaikkein halvin ja tehokkain sovellettavaksi kaikkien viljelykasvien osalta edeltävänä aikana.

Ammoniakkiveden tuotanto kulutetaan vuonnakolme kertaa pienempi kuin kiinteiden rakeisten typpilannoitteiden vapautuminen. Nesteiden varastointiin ja kuljetukseen käytetään ilmatiiviisti suljettuja teräsvesiä. Joitakin maaleja ja hiusvalkaisuaineita valmistetaan käyttäen syövyttävää ammoniumia. Jokaisessa lääketieteellisessä laitoksessa on ammoniakkia sisältäviä huumeita - 10-prosenttinen ammoniakkiliuos.
Ammoniumsuolat: ominaisuudet ja käytännön merkitys

Aineet, jotka saadaan vuorovaikutuksellaammoniumhydroksidia happojen kanssa, käytetään taloudellisessa toiminnassa. Suolat hajoavat kuumentuessaan, liukenevat veteen ja hydrolyysi. Ne alkavat käydä kemiallisilla reaktioilla alkalien ja muiden aineiden kanssa. Tärkein käytännön merkitys oli kloridien, nitraattien, sulfaattien, fosfaattien ja ammoniumkarbonaattien hankkiminen.
On erittäin tärkeää noudattaa sääntöjä ja toimenpiteitäturvallisuutta, työskentelemällä ammoniumioniä sisältävien aineiden kanssa. Kun varastoidaan teollisuus- ja maatalousyritysten varastoissa, tytäryhtiöissä ei saa olla kosketuksissa tällaisia yhdisteitä kalkilla ja alkaloilla. Jos pakkausten tiiviys on rikki, kemiallinen reaktio alkaa myrkyllisen kaasun vapautumisella. Jokaisen, joka joutuu työskentelemään ammoniakin ja sen suolojen kanssa, on tunnettava kemian perusteet. Jos turvallisuusvaatimukset täyttyvät, käytetyt aineet eivät vahingoita ihmisiä ja ympäristöä.



